Российские и зарубежные химики заявляют о возможности существования двух стабильных соединений самого «ксенофобского» элемента – гелия, и экспериментально подтвердили существования одного из них – гелида натрия, говорится в статье, опубликованной в журнале Nature Chemistry.
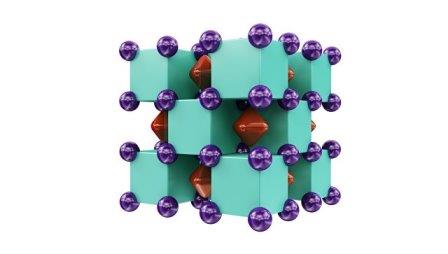
Модель гелида натрия
© Арт ем Ога нов / МФТИ
«Данное исследование демонстрирует, как совершенно неожиданные явления могут быть обнаружены с помощью самых современных теоретических и экспериментальных методов. Наша работа в очередной раз иллюстрирует, насколько мало на сегодняшний день мы знаем о влиянии экстремальных условий на химию, и роль таких явлений на процессы внутри планет ещё предстоит объяснить», — рассказывает Артем Оганов, профессор Сколтеха и Московского Физтеха в Долгопрудном.
Тайны благородных газов
Первичная материя Вселенной, возникшая через несколько сотен миллионов лет после Большого Взрыва, состояла всего из трех элементов – водорода, гелия и следовых количеств лития. Гелий и сегодня является третьим по распространенности элементом мироздания, однако на Земле его встречается крайне мало, и запасы гелия на планете постоянно уменьшаются из-за того, что он улетучивается в космос.
Отличительной чертой гелия и других элементов восьмой группы таблицы Менделеева, которых ученые называют «благородными газами», является то, что они крайне неохотно – в случае ксенона и других тяжелых элементов – или в принципе, как неон, не способны вступать в химические реакции. Существует лишь несколько десятков соединений ксенона и криптона с фтором, кислородом и другими сильными окислителями, ноль соединений неона и одно соединение гелия, обнаруженное экспериментальным путем в 1925 году.
Это соединение, объединение протона и гелия, не является настоящим химическим соединением в строгом смысле этого слова – гелий в данном случае не участвует в образовании химических связей, хотя и влияет на поведение атомов водорода, лишенных электрона. Как раньше предполагали химики, «молекулы» этого вещества должны были встречаться в межзвездной среде, однако за последние 90 лет астрономы так и не обнаружили их. Возможной причиной этого является то, что данный ион крайне нестабилен и разрушается при контакте с почти любой другой молекулой.
Артем Оганов и его команда задумались, могут ли соединения гелия существовать при экзотических условиях, о которых земные химики задумываются крайне редко – при сверхвысоких давлениях и температурах. Оганов и его коллеги достаточно давно изучают подобную «экзотическую» химию и даже разработали специальный алгоритм для поиска веществ, существующих в таких условиях. При его помощи они обнаружили, что в недрах газовых гигантов и некоторых других планет может существовать экзотическая ортоугольная кислота, «невозможные» версии обычной поваренной соли, и ряд других соединений, «нарушающих» законы классической химии.
Используя эту же систему, USPEX, российские и зарубежные ученые обнаружили, что при сверхвысоких давлениях, превышающих атмосферное в 150 тысяч и миллион раз, существует сразу два стабильных соединения гелия – оксигелид натрия и гелид натрия. Первое соединение состоит из двух атомов натрия и одного атома гелия, а второе – из кислорода, гелия и двух атомов натрия.
Атом на алмазной наковальне
И то, и другое давление можно легко получить при помощи современных алмазных наковален, что и сделали коллеги Оганова под руководством другого россиянина — Александра Гончарова из Геофизической лаборатории в Вашингтоне. Как показали его опыты, гелид натрия формируется при давлении примерно в 1,1 миллиона атмосфер и остается стабильным как минимум до 10 миллионов атмосфер.
Что интересно, гелид натрия похож по своей структуре и свойствам на соли фтора, «соседа» гелия по периодической таблице. Каждый атом гелия в этой «соли» окружен восьмью атомами натрия, подобно тому, как устроен фторид кальция или любая другая соль плавиковой кислоты. Электроны в Na2He «притянуты» к атомам так сильно, что это соединение, в отличие от натрия, является изолятором. Подобные структуры ученые называют ионными кристаллами, так как электроны занимают в них роль и место отрицательно заряженных ионов.
«Открытое нами соединение весьма необычно: хотя атомы гелия напрямую не участвуют в химической связи, их присутствие фундаментально меняет химические взаимодействия между атомами натрия, способствуя сильной локализации валентных электронов, что делает полученный материал изолятором», — поясняет Сяо Дун (Xiao Dong) из университета Нанканя в Тяньцзине (Китай).
Другое соединение — Na2HeO — оказалось стабильным в диапазоне давлений от 0,15 до 1,1 миллиона атмосфер. Вещество также является ионным кристаллом и имеет схожее с Na2He строение, только роль отрицательно заряженных ионов в них играют не электроны, а атомы кислорода.
Что интересно, все остальные щелочные металлы, обладающие более высокой реактивностью, гораздо менее охотно образуют соединения с гелием при давлениях, превышающих атмосферное не более чем в 10 миллионов раз.
Оганов и его коллеги связывают это с тем, что орбиты, по которым движутся электроны в атомах калия, рубидия и цезия, заметным образом меняются при повышении давления, чего с натрием, по пока не понятным причинам, не происходит. Как полагают ученые, гелид натрия и другие подобные вещества могут встречаться в ядрах некоторых планет, белых карликов и прочих звезд.
Источник: Р И А Новости